ЁЁЁЁ2023Фъ8дТ31ШеЃЌЪаіБO(jiЈЁn)ЙмПОжў(huЈЌ)ЭЌјМваl(wЈЈi)ЩњНЁПЕЮЏЁЂјМвжасt(yЈЉ)ЫОжжЦЖЈВЂТ(liЈЂn)КЯАl(fЈЁ)ВМЁЖдЪдSБЃНЁЪГЦЗТЗQЕФБЃНЁЙІФмФПф ЗЧ I№B(yЈЃng)Ыибa(bЈГ)ГфЉЃЈ2023ФъАцЃЉЁЗЃЈвдЯТКЗQЁЖФПфЁЗЃЉМАХфЬзЮФМўЁЃХфЬзЮФМўжае§ЪНЬсГіІ(duЈЌ)гквбХњЪ(zhЈГn)зЂд(cЈЈ)ЕФЎa(chЈЃn)ЦЗжазЂд(cЈЈ)зCјЁАoгааЇЦкКЭoЎa(chЈЃn)ЦЗММаg(shЈД)вЊЧѓЁБЕФЎa(chЈЃn)ЦЗЃЈвдЯТКЗQЁАыpoЁБЎa(chЈЃn)ЦЗЃЉеЙщ_QзCЙЄзїЁЃ
ЁЁЁЁ2023Фъ12дТ27ШеЃЌЪаіБO(jiЈЁn)ЙмПОжАl(fЈЁ)ВМЙЋщ_еїЧѓЁЖдкЎa(chЈЃn)дкЪлЁАыpoЁББЃНЁЪГЦЗМЏжаQзCВщвЊќc(diЈЃn)ЃЈеїЧѓвтвИхЃЉЁЗЃЈвдЯТКЗQЁАвтвИхЁБЃЉвтвЕФЙЋИцЁЃ2024Фъ11дТ1ШеЃЌЪаіБO(jiЈЁn)ЙмПОжАl(fЈЁ)ВМЁЖдкЎa(chЈЃn)дкЪлЁАoгааЇЦкКЭoЎa(chЈЃn)ЦЗММаg(shЈД)вЊЧѓЁББЃНЁЪГЦЗМЏжаQзCВщвЊќc(diЈЃn)ЁЗЃЈвдЯТКЗQЁЖQзCВщвЊќc(diЈЃn)ЁЗЃЉЁЃ
ЁЁЁЁЪГЦЗЛяАщОW(wЈЃng)ПНY(jiЈІ)СЫЁЖQзCВщвЊќc(diЈЃn)ЁЗЯрБШЁАвтвИхЁБЕФжївЊзЛЏЃЌЪсРэСЫЦѓI(yЈЈ)Иљў(jЈД)ЁЖQзCВщвЊќc(diЈЃn)ЁЗщ_еЙЁАыpoЁБЎa(chЈЃn)ЦЗQзCЕФЙЄзївЊќc(diЈЃn)ЃЌвдЙЉ
ЂПМЁЃ
вЛЁЂЁЖQзCВщвЊќc(diЈЃn)ЁЗЯрБШЁАвтвИхЁБЕФжївЊзЛЏ
ЁЁЁЁЃЈвЛЃЉЪЁМ(jЈЊ)ОжЬсГіЕФQзCвтв
ЁЁЁЁЁЖQзCВщвЊќc(diЈЃn)ЁЗв(guЈЉ)ЖЈКЫАl(fЈЁ)ЩњЎa(chЈЃn)дSПЩЕФЪЁМ(jЈЊ)ОжЬсГіЕФQзCвтвгЩЦфѓ(bЈЄo)ЫЭЪаіБO(jiЈЁn)ЙмПОжЃЌВЂГЫЭзЂд(cЈЈ)ШЫЃЌВЛВЩгУЁАвтвИхЁБMгЩзЂд(cЈЈ)ШЫЯђЪаіБO(jiЈЁn)ЙмПОжЬсНЛЪЁМ(jЈЊ)ОжГіОпЕФQзCвтвЕФНЈзhЃЛ
ЁЁЁЁhГ§СЫзЂд(cЈЈ)ШЫІ(duЈЌ)ЪЁМ(jЈЊ)ОжвтвЫљИНЎa(chЈЃn)ЦЗММаg(shЈД)вЊЧѓпM(jЈЌn)аааогr(shЈЊ)ЕФйYСЯвЊЧѓЃЌБэУїЩъе(qЈЋng)ШЫВЛФмІ(duЈЌ)ЪЁМ(jЈЊ)ОжвтвЫљИНЎa(chЈЃn)ЦЗММаg(shЈД)вЊЧѓпM(jЈЌn)аааогЃЛ
ЁЁЁЁhГ§СЫЁАвтвИхЁБжавЊЧѓЪЁМ(jЈЊ)ОжГіОпзЂд(cЈЈ)ШЫжїѓwйYй|(zhЈЌ)ЧщrД_еJ(rЈЈn)втвЕФв(guЈЉ)ЖЈЁЃ
ЁЁЁЁЃЈЖўЃЉЩъе(qЈЋng)ШЫжїѓwйYй|(zhЈЌ)ЯръP(guЈЁn)
ЁЁЁЁЁЖQзCВщвЊќc(diЈЃn)ЁЗhГ§СЫЁАвтвИхЁБІ(duЈЌ)гкзЂд(cЈЈ)ШЫЬгкзЂфNЁЂЕѕфNЁЂСаШыН(jЈЉng) IЎГЃУћфЛђп`ЗЈЪЇаХЦѓI(yЈЈ)УћЮЕШЎГЃЧщаЮЕФЃЌКЭЃЪмРэЕФв(guЈЉ)ЖЈЃЛ
ЁЁЁЁдіМгСЫдзЂд(cЈЈ)ШЫгаЖр(gЈЈ)жїѓwЕЋВПЗжжїѓwзЂфNr(shЈЊ)ЃЌДцРm(xЈД)зЂд(cЈЈ)ШЫдкQзCr(shЈЊ)Њ(yЈЉng)ЬсНЛЕФЎa(chЈЃn)ЦЗзЂд(cЈЈ)зCјwйр(quЈЂn)ТУїЛђЩцМАЕФр(quЈЂn)РћСxе(wЈД)o зhГажZјМАеfУїЕШйYСЯвЊЧѓЁЃ
ЁЁЁЁЃЈШ§ЃЉдСЯЯръP(guЈЁn)
ЁЁЁЁІ(duЈЌ)гкдСЯгУСПЛђдСЯЗNю(gЈЈ)Е(shЈД)ЕШГЌГіЌF(xiЈЄn)аав(guЈЉ)ЖЈЕФЧщrЃЌЁЖQзCВщвЊќc(diЈЃn)ЁЗдіМгСЫвРў(jЈД)Ўa(chЈЃn)ЦЗщLЦкЪГгУЕФАВШЋадезCѓ(bЈЄo)ИцЃЌН(jЈЉng)дu(pЈЊng)ЙРашвЊНЕЕЭдСЯгУСПЕФЃЌдкЪеЕНВЛгшХњЪ(zhЈГn)QзCвтвКѓЃЌжиаТпM(jЈЌn)ааQзCЩъе(qЈЋng)r(shЈЊ)ЃЌПЩУтгкЬсЙЉMНЕЕЭдСЯгУСПКѓЎa(chЈЃn)ЦЗЕФАВШЋаддu(pЈЊng)r(jiЈЄ)дђ(yЈЄn)ВФСЯЃЌЕЋашЬсЙЉБЃНЁЙІФмдu(pЈЊng)r(jiЈЄ)ВФСЯКЭаl(wЈЈi)ЩњW(xuЈІ)ЁЂЗ(wЈЇn)ЖЈадЁЂЙІаЇГЩЗж/Ы(biЈЁo)жОадГЩЗжzyЕШдђ(yЈЄn)ѓ(bЈЄo)ИцЃЌезCЎa(chЈЃn)ЦЗБЃНЁЙІФмХcй|(zhЈЌ)СППЩПиадЕФв(guЈЉ)ЖЈЁЃ
ЁЁЁЁІ(duЈЌ)гкАДееЌF(xiЈЄn)аав(guЈЉ)ЖЈе{(diЈЄo)ећЎa(chЈЃn)ЦЗХфЗНЃЈКЌЬцQЛђШЅГ§дСЯЃЉЕФЃЌЁЖQзCВщвЊќc(diЈЃn)ЁЗдіМгСЫАДееЌF(xiЈЄn)аааТЎa(chЈЃn)ЦЗзЂд(cЈЈ)вЊЧѓЬсНЛЎa(chЈЃn)ЦЗХфЗНЁЂЩњЎa(chЈЃn)ЙЄЫЁЂЫ(biЈЁo)КеfУїјгИхЁЂЎa(chЈЃn)ЦЗММаg(shЈД)вЊЧѓЕШбаАl(fЈЁ)йYСЯЕФвЊЧѓЁЃ
ЖўЁЂАДееЁЖQзCВщвЊќc(diЈЃn)ЁЗпM(jЈЌn)ааЁАыpoЁБЎa(chЈЃn)ЦЗQзCr(shЈЊ)ЕФЙЄзївЊќc(diЈЃn)
ЁЁЁЁЃЈвЛЃЉQзCЗЖњ
ЁЁЁЁп^ЖЩЦкЃЈ2023Фъ8дТ31ШеЦ№5ФъШ(nЈЈi)ЃЉШ(nЈЈi)дкЎa(chЈЃn)дкЪлЕФјЎa(chЈЃn)КЭпM(jЈЌn)ПкЁАыpoЁБЎa(chЈЃn)ЦЗЁЃ
ЁЁЁЁЃЈЖўЃЉQзCГЬађ
ЁЁЁЁ1ЁЂзЂд(cЈЈ)ШЫЯђЪаіБO(jiЈЁn)ЙмПОжЬсГізИќЩъе(qЈЋng)
ЁЁЁЁзЂд(cЈЈ)ШЫАДееЁЖQзCКЫВщвЊќc(diЈЃn)ЁЗЕФв(guЈЉ)ЖЈЪ(zhЈГn)фQзCйYСЯЃЌВЂЯђЪаіБO(jiЈЁn)ЙмПОжЬсГізИќЩъе(qЈЋng)ЃЌзИќзЂд(cЈЈ)юeщЁАыpoЁБQзCЁЃ
ЁЁЁЁ2ЁЂЪЁМ(jЈЊ)ОжГіОпQзCвтв
ЁЁЁЁЪЁМ(jЈЊ)ЪаіБO(jiЈЁn)ЙмВПщTИљў(jЈД)Ўa(chЈЃn)ЦЗ(shЈЊ)ыHЩњЎa(chЈЃn)ЕФММаg(shЈД)вЊЧѓКЭБO(jiЈЁn)ЙмЧщrЃЌвРў(jЈД)ЌF(xiЈЄn)ааЗЈТЩЗЈв(guЈЉ)ЬсГіЎa(chЈЃn)ЦЗQзCвтвЃЌѓ(bЈЄo)ЫЭЪаіБO(jiЈЁn)ЙмПОжЃЌВЂГЫЭзЂд(cЈЈ)ШЫЁЃ
ЁЁЁЁ3ЁЂММаg(shЈД)дu(pЈЊng)
ЁЁЁЁдu(pЈЊng)C(jЈЉ)(gЈАu)ЃЈЪаіБO(jiЈЁn)ЙмПОжЪГЦЗдu(pЈЊng)жааФЃЉАДееЌF(xiЈЄn)ааЗЈТЩЗЈв(guЈЉ)Ы(biЈЁo)Ъ(zhЈГn)МАгаъP(guЈЁn)в(guЈЉ)ЖЈщ_еЙQзCдu(pЈЊng)ЃЌВЂЂдu(pЈЊng)НY(jiЈІ)еѓ(bЈЄo)ЫЭЪаіБO(jiЈЁn)ЙмПОжХњЁЃ
ЁЁЁЁ4ЁЂааеўХњ
ЁЁЁЁЗћКЯвЊЧѓЕФЃЌQАl(fЈЁ)аТЕФзЂд(cЈЈ)зCјЃЌзЂд(cЈЈ)Ь(hЈЄo)ИќаТщЁАјЪГНЁзЂG/JФъДњЬ(hЈЄo)+ађЬ(hЈЄo)ЁБЃЈЦфжаЁАФъДњЬ(hЈЄo)+ађЬ(hЈЄo)ЁБВЛзЃЉЃЌзCјфзЂкЫ(biЈЁo)зЂдЎa(chЈЃn)ЦЗУћЗQЁЂдЎa(chЈЃn)ЦЗзЂд(cЈЈ)Ь(hЈЄo)МАЁАдзЂд(cЈЈ)зCјQзCКѓЪЇаЇЁБЁЃ
ЁЁЁЁВЛЗћКЯвЊЧѓЕФЃЌВЛгшХњЪ(zhЈГn)QзCЩъе(qЈЋng)ЁЃзЂд(cЈЈ)ШЫПЩвРў(jЈД)в(guЈЉ)ЖЈвЊЧѓжиаТЬсГіQзCЩъе(qЈЋng)ЁЃ
ЁЁЁЁQАl(fЈЁ)ЕФзЂд(cЈЈ)зCјЛђВЛгшзЂд(cЈЈ)QЖЈјЃЌЭЌr(shЈЊ)ГЫЭзЂд(cЈЈ)ШЫЫљдкЕиКЭКЫАl(fЈЁ)ЩњЎa(chЈЃn)дSПЩЕФЪЁМ(jЈЊ)ЪаіБO(jiЈЁn)ЙмВПщTЁЃ
ЁЁЁЁЃЈШ§ЃЉЙЄзївЊќc(diЈЃn)
ЁЁЁЁ1ЁЂЩъе(qЈЋng)ШЫжїѓwйYй|(zhЈЌ)
ЁЁЁЁQзCЩъе(qЈЋng)ШЫЊ(yЈЉng)Ў(dЈЁng)щзЂд(cЈЈ)ШЫЁЃпM(jЈЌn)ПкЎa(chЈЃn)ЦЗЕФзЂд(cЈЈ)ШЫщОГЭтЩњЎa(chЈЃn)SЩЬЁЃ
ЁЁЁЁ2ЁЂQзCвтвГіОпЮЮЛ
ЁЁЁЁЁАыpoЁБЎa(chЈЃn)ЦЗQзCвтвгЩКЫАl(fЈЁ)ЩњЎa(chЈЃn)дSПЩЕФЪЁМ(jЈЊ)ЪаіБO(jiЈЁn)ЙмВПщTГіОпЃЌМДЎa(chЈЃn)ЦЗ(shЈЊ)ыHЩњЎa(chЈЃn)ЦѓI(yЈЈ)ЫљдкЕиЕФЪЁМ(jЈЊ)ОжЃЌЖјВЛЪЧзЂд(cЈЈ)ШЫЫљдкЕиЕФЪЁМ(jЈЊ)ОжЁЃ
ЁЁЁЁ3ЁЂЎa(chЈЃn)ЦЗУћЗQ
ЁЁЁЁЎa(chЈЃn)ЦЗУћЗQЊ(yЈЉng)Ў(dЈЁng)ЗћКЯЌF(xiЈЄn)аагаъP(guЈЁn)в(guЈЉ)ЖЈЁЃБЃСєЎa(chЈЃn)ЦЗдУћЗQЕФЃЌРэгЩЊ(yЈЉng)Ў(dЈЁng)ГфЗжКЯРэЁЃЎa(chЈЃn)ЦЗУћЗQЕФЌF(xiЈЄn)аагаъP(guЈЁn)в(guЈЉ)ЖЈжИЃКЁЖБЃНЁЪГЦЗУќУћжИФЯЃЈ2019ФъАцЃЉЁЗЕкЫФВПЗжЕкЃЈЖўЃЉlЕк5ПюЃЌЁАвбЋ@ЕУХњЪ(zhЈГn)зCјЕФБЃНЁЪГЦЗЃЌЦфЎa(chЈЃn)ЦЗУћЗQГ§ВЛЗћКЯБОlПюв(guЈЉ)ЖЈЭтЃЌЗћКЯБОжИФЯЦфЫћЯръP(guЈЁn)в(guЈЉ)ЖЈЕФЃЌЩъе(qЈЋng)ШЫПЩЬсГіГфЗжКЯРэЕФРэгЩЩъе(qЈЋng)БЃСєдЎa(chЈЃn)ЦЗУћЗQЁБЁЃ
ЁЁЁЁе{(diЈЄo)ећЎa(chЈЃn)ЦЗУћЗQЕФЃЌПЩдкаТЕФЎa(chЈЃn)ЦЗУћЗQКѓРЈЬ(hЈЄo)Ш(nЈЈi)Ы(biЈЁo)зЂЎa(chЈЃn)ЦЗдУћЗQЃЌЪЙгУжСБОДЮQАl(fЈЁ)зCјгааЇЦкНY(jiЈІ)ЪјЁЃ
ЁЁЁЁ4ЁЂпM(jЈЌn)ПкЁАыpoЁБЎa(chЈЃn)ЦЗQзC
ЁЁЁЁІ(duЈЌ)гкдкЎa(chЈЃn)дкЪлЁАыpoЁБпM(jЈЌn)ПкЎa(chЈЃn)ЦЗЃЌЯръP(guЈЁn)ВФСЯЗћКЯЁЖQзCКЫВщвЊќc(diЈЃn)ЁЗв(guЈЉ)ЖЈЕФЃЌзЂд(cЈЈ)ШЫАДеевЊЧѓжБНгЬсГіQзCЩъе(qЈЋng)ЁЃЯрБШјЎa(chЈЃn)ЁАыpoЁБЎa(chЈЃn)ЦЗQзCЬсНЛЕФйYСЯЃЌпЊ(yЈЉng)Ў(dЈЁng)ЬсНЛЮЏЭајЁЂОГЭтЩњЎa(chЈЃn)SЩЬЕФйYй|(zhЈЌ)зCУїЮФМўЁЂЩњЎa(chЈЃn)ЦѓI(yЈЈ)й|(zhЈЌ)СПЙмРэѓwЯЕзCУїЮФМўЁЂЩЯЪафNЪлЕФзCУїЮФМўЁЂОГЭтфNЪлЛђпM(jЈЌn)ПкфNЪлЕФзюаЁфNЪлАќбb(shЈЊ)гЁЂзЂд(cЈЈ)ШЫЃЈОГЭтЩњЎa(chЈЃn)SЩЬЃЉдкЮвјГіШыОГzђ(yЈЄn)zвпВПщTЕФфАИЛђзЂд(cЈЈ)аХЯЂКЭЎa(chЈЃn)ЦЗпM(jЈЌn)ПкаХЯЂЁЃ
ЁЁЁЁ5ЁЂQзCЩцМАzyЕФвЊЧѓ

аЁНY(jiЈІ)ЃК
ЁЁЁЁЁЖQзCКЫВщвЊќc(diЈЃn)ЁЗжМдкМЏжав(guЈЉ)ЗЖдкЎa(chЈЃn)дкЪлЁАыpoЁБЎa(chЈЃn)ЦЗзЂд(cЈЈ)зCјЃЌдO(shЈЈ)СЂзЂд(cЈЈ)зCјгааЇЦкЃЌв(guЈЉ)ЗЖБЃНЁЙІФмТЗQЃЌЭъЩЦЎa(chЈЃn)ЦЗЫ(biЈЁo)КеfУїјгИхЁЂЎa(chЈЃn)ЦЗММаg(shЈД)вЊЧѓКЭЎa(chЈЃn)ЦЗnАИаХЯЂЃЌQАl(fЈЁ)БЃНЁЪГЦЗзЂд(cЈЈ)зCјЃЌ(shЈЊ)ЌF(xiЈЄn)БЃНЁЪГЦЗзЂд(cЈЈ)ХcЩњЎa(chЈЃn)дSПЩЁЂБO(jiЈЁn)ЖНЙмРэуНгЃЌТф(shЈЊ)ТфМ(xЈЌ)ЩњЎa(chЈЃn)ЦѓI(yЈЈ)жїѓwи(zЈІ)ШЮКЭйЕиБO(jiЈЁn)ЙмВПщTБO(jiЈЁn)Йми(zЈІ)ШЮЁЃ
ЁЁЁЁЁЖQзCКЫВщвЊќc(diЈЃn)ЁЗЕФАl(fЈЁ)ВМвтЮЖжјЁАыpoЁБЎa(chЈЃn)ЦЗQзCЕФе§ЪНщ_ЪМЃЌЦфдМ(xЈЌ)в(guЈЉ)ЖЈСЫЁАыpoЁБЎa(chЈЃn)ЦЗQзCЕФСїГЬМАзИќЩъе(qЈЋng)йYСЯвЊЧѓЃЌІ(duЈЌ)ЯръP(guЈЁn)ЦѓI(yЈЈ)ОпгаУїД_ЕФжИЪОзїгУЃЌгаРћгкећ(gЈЈ)ааI(yЈЈ)ЕФв(guЈЉ)ЗЖМАПЩГжРm(xЈД)Аl(fЈЁ)еЙЁЃ
ЁЁЁЁвдЩЯЪЧЪГЦЗЛяАщОW(wЈЃng)І(duЈЌ)ЁЖQзCКЫВщвЊќc(diЈЃn)ЁЗЕФЪсРэКЭПНY(jiЈІ)ЃЌЪГЦЗЛяАщОW(wЈЃng)ЂІ(duЈЌ)БЃНЁЪГЦЗМАЦфЫћЬиЪтЪГЦЗЯръP(guЈЁn)ЕФЗЈв(guЈЉ)пM(jЈЌn)ааГжРm(xЈД)адЕФИќаТХcНтзxЃЌОДе(qЈЋng)ЦкД§ЁЃ
ИНМўЃК
дЙІФмW(xuЈІ)дђ(yЈЄn)дu(pЈЊng)r(jiЈЄ)вРў(jЈД)щдаl(wЈЈi)ЩњВПАl(fЈЁ)ВМЁЖБЃНЁЪГЦЗЙІФмW(xuЈІ)дu(pЈЊng)r(jiЈЄ)ГЬађКЭzђ(yЈЄn)ЗНЗЈЃЈ1996 АцЃЉЁЗЕФ8ЗNЙІФмЕФаТХfБЃНЁЙІФмТЗQІ(duЈЌ)Њ(yЈЉng)ъP(guЈЁn)ЯЕКЭЙІФмдu(pЈЊng)r(jiЈЄ)уНгвЊЧѓЁЃ
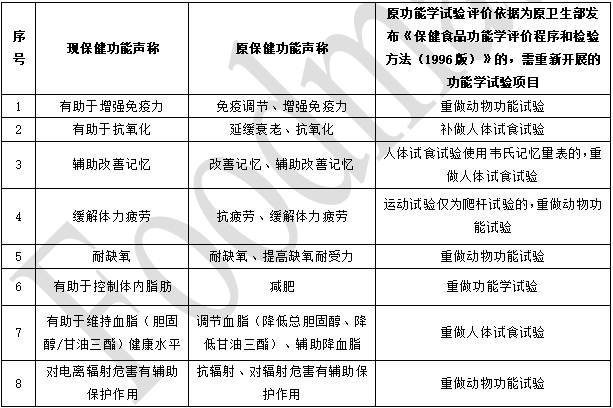
ИНМўЃК
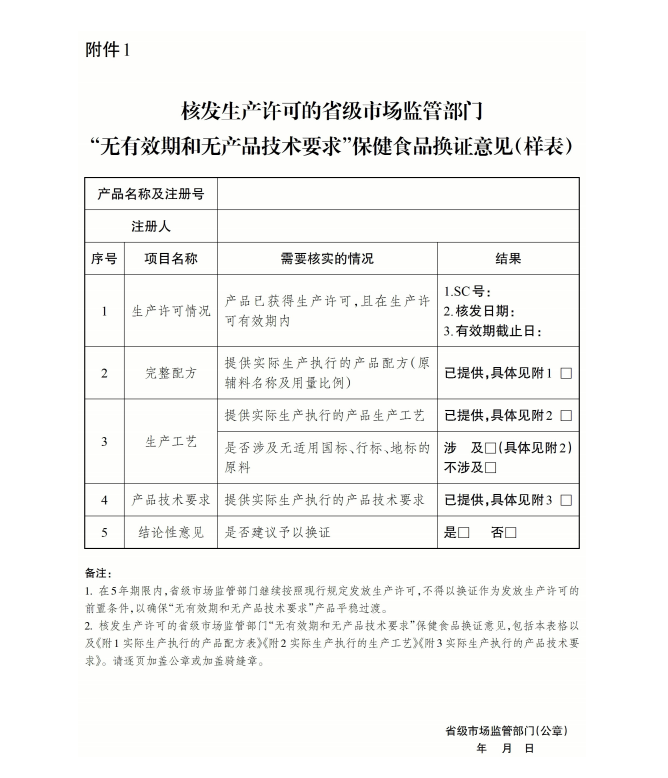
ЁЁЁЁЁЖдкЎa(chЈЃn)дкЪлЁАoгааЇЦкКЭoЎa(chЈЃn)ЦЗММаg(shЈД)вЊЧѓЁББЃНЁЪГЦЗМЏжаQзCВщвЊќc(diЈЃn)ЁЗвбН(jЈЉng)2024Фъ10дТ28ШеЪаіБO(jiЈЁn)ЙмПОжЕк27ДЮОже(wЈД)ў(huЈЌ)зhЭЈп^ЃЌ ЌF(xiЈЄn)гшЙЋИцЃЌ здАl(fЈЁ)ВМжЎШеЦ№ЪЉааЁЃ
ЁЁЁЁЪаіБO(jiЈЁn)ЙмПОж
ЁЁЁЁ2024Фъ10дТ30Ше









 ЪжC(jЈЉ)Ац
ЪжC(jЈЉ)Ац






![р]Яф](https://img.foodmate.net/foodmate/img/zhiliangem.jpg)
